Công Thức E Của Nh4+, hay còn gọi là ion amoni, là một khái niệm cơ bản trong hóa học. Bài viết này sẽ đi sâu vào phân tích cấu trúc, tính chất và ứng dụng của NH4+ trong đời sống, giúp bạn hiểu rõ hơn về vai trò quan trọng của nó. công thức phân tử của amoniac cũng có liên quan mật thiết đến NH4+.
Cấu Trúc và Hình Thành của Ion Amoni (NH4+)
Ion amoni (NH4+) được hình thành khi một phân tử amoniac (NH3) nhận thêm một proton (H+). Nguyên tử nitơ trong NH3 có một cặp electron tự do, và cặp electron này tạo liên kết phối trí với H+, tạo thành ion NH4+ mang điện tích dương. Quá trình này có thể được biểu diễn bằng phương trình: NH3 + H+ → NH4+. Cấu trúc của NH4+ là hình tứ diện đều, với nguyên tử nitơ ở trung tâm và bốn nguyên tử hydro ở bốn đỉnh.
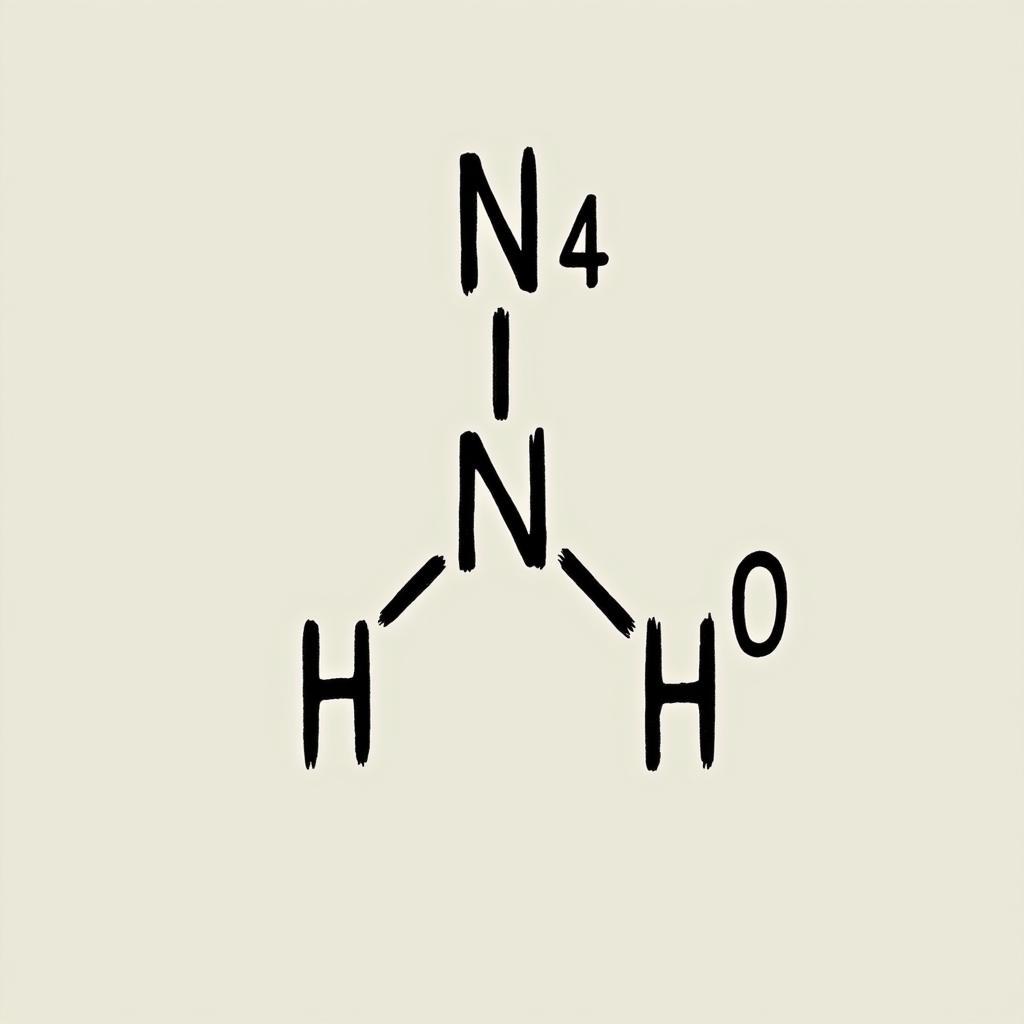 Cấu trúc ion amoni
Cấu trúc ion amoni
Tính Chất của NH4+
NH4+ có tính chất hóa học tương tự như các ion kim loại kiềm. Nó có thể tạo thành muối với các anion khác nhau, ví dụ như amoni clorua (NH4Cl), amoni sunfat ((NH4)2SO4), công thức của muối sunfat. cho 0 1 mol x có công thức c3h12o3n2 có liên quan đến các phản ứng hóa học phức tạp hơn. Trong dung dịch nước, NH4+ có thể bị thủy phân tạo thành NH3 và H3O+, làm cho dung dịch có tính axit nhẹ.
Phản Ứng Đặc Trưng của NH4+
Một phản ứng đặc trưng để nhận biết NH4+ là phản ứng với dung dịch kiềm mạnh, chẳng hạn như NaOH. Khi đun nóng, NH3 sẽ được giải phóng và có thể được nhận biết bằng mùi khai đặc trưng hoặc bằng quỳ tím ẩm chuyển sang màu xanh.
Ứng Dụng của NH4+ trong Đời Sống
NH4+ có nhiều ứng dụng quan trọng trong đời sống, đặc biệt là trong nông nghiệp và công nghiệp.
- Phân bón: Các muối amoni như amoni nitrat (NH4NO3) và amoni sunfat ((NH4)2SO4) là nguồn cung cấp nitơ quan trọng cho cây trồng.
- Xử lý nước thải: NH4+ có thể được sử dụng trong quá trình xử lý nước thải để loại bỏ các chất ô nhiễm.
- Sản xuất chất nổ: Amoni nitrat cũng được sử dụng trong sản xuất chất nổ. phèn chua có công thức nào sau đây cũng có ứng dụng trong xử lý nước.
- Chất tẩy rửa: Một số chất tẩy rửa có chứa NH4+ để tăng hiệu quả làm sạch.
 Ứng dụng phân bón amoni
Ứng dụng phân bón amoni
What công thức e của NH4+?
Công thức e của NH4+ biểu diễn sự phân bố electron trong ion amoni.
Who sử dụng công thức e của NH4+?
Các nhà hóa học và học sinh, sinh viên học hóa học sử dụng công thức e của NH4+ để hiểu về cấu trúc và tính chất của nó.
When cần biết công thức e của NH4+?
Khi nghiên cứu về hóa học vô cơ, phản ứng axit-bazơ, và các ứng dụng của hợp chất amoni.
Where tìm thấy NH4+?
NH4+ có thể được tìm thấy trong phân bón, nước thải, và một số sản phẩm công nghiệp.
Why NH4+ quan trọng?
NH4+ quan trọng vì vai trò của nó trong nông nghiệp, công nghiệp và môi trường. cho 0.1 mol x có công thức phân tủ c3h12o3n2 cung cấp ví dụ về ứng dụng của các hợp chất chứa nitơ.
How NH4+ được hình thành?
NH4+ được hình thành khi NH3 nhận một proton (H+).
Trích dẫn từ chuyên gia: “Ion amoni là một ví dụ điển hình về liên kết phối trí, một khái niệm quan trọng trong hóa học,” – GS.TS Nguyễn Văn A, chuyên gia hóa học vô cơ.
Kết Luận
Công thức e của NH4+ là một kiến thức cơ bản nhưng quan trọng để hiểu về tính chất và ứng dụng của ion amoni. Hi vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về NH4+.
FAQ
- NH4+ là gì? NH4+ là ion amoni, hình thành khi NH3 nhận một proton.
- Ứng dụng chính của NH4+ là gì? Ứng dụng chính của NH4+ là trong sản xuất phân bón.
- Tại sao NH4+ quan trọng trong nông nghiệp? NH4+ là nguồn cung cấp nitơ quan trọng cho cây trồng.
- Làm thế nào để nhận biết NH4+? Có thể nhận biết NH4+ bằng phản ứng với dung dịch kiềm mạnh, giải phóng khí NH3 có mùi khai.
- NH4+ có độc hại không? Ở nồng độ cao, NH4+ có thể gây độc hại.
- Công thức hóa học của amoni clorua là gì? Công thức hóa học của amoni clorua là NH4Cl.
- NH4+ có tính axit hay bazơ? NH4+ có tính axit nhẹ.
- Cấu trúc của NH4+ là gì? NH4+ có cấu trúc tứ diện đều.
- Phân bón nào chứa NH4+? Amoni nitrat (NH4NO3) và amoni sunfat ((NH4)2SO4) là các loại phân bón chứa NH4+.
- NH4+ có vai trò gì trong xử lý nước thải? NH4+ có thể được sử dụng để loại bỏ các chất ô nhiễm trong nước thải.
