Lưu huỳnh đioxit (SO2) là một hợp chất hóa học quan trọng với công thức Lewis đặc trưng. Việc hiểu rõ Công Thức Lewis Của So2 không chỉ giúp bạn nắm bắt cấu trúc phân tử mà còn dự đoán được tính chất và phản ứng hóa học của nó. Bài viết này sẽ đi sâu phân tích công thức Lewis của SO2, cùng với những khía cạnh liên quan đến hợp chất này.
Khám Phá Cấu Trúc Phân Tử SO2 Qua Công Thức Lewis
Công thức Lewis là một biểu diễn đồ họa đơn giản về cấu trúc electron của một phân tử. Nó cho thấy cách các nguyên tử liên kết với nhau bằng cách chia sẻ các cặp electron. Đối với SO2, công thức Lewis thể hiện sự liên kết giữa nguyên tử lưu huỳnh (S) và hai nguyên tử oxy (O).
Vẽ Công Thức Lewis Của SO2: Hướng Dẫn Từng Bước
Để vẽ công thức Lewis của SO2, chúng ta cần tuân theo các bước sau:
- Xác định tổng số electron hóa trị: Lưu huỳnh (S) có 6 electron hóa trị và mỗi oxy (O) có 6 electron hóa trị. Tổng cộng có 6 + 6*2 = 18 electron hóa trị.
- Chọn nguyên tử trung tâm: Nguyên tử lưu huỳnh (S) là nguyên tử trung tâm vì nó ít âm điện hơn oxy.
- Nối các nguyên tử bằng liên kết đơn: Nối nguyên tử S với mỗi nguyên tử O bằng một liên kết đơn. Điều này sử dụng 4 electron (2 liên kết * 2 electron/liên kết).
- Phân bổ electron còn lại cho các nguyên tử oxy: Phân bổ các electron còn lại (18 – 4 = 14 electron) cho các nguyên tử oxy để đạt được cấu hình octet (8 electron lớp ngoài cùng).
- Kiểm tra cấu hình octet của nguyên tử trung tâm: Nếu nguyên tử trung tâm chưa đạt octet, ta cần chuyển electron từ nguyên tử oxy để tạo liên kết đôi. Trong trường hợp SO2, nguyên tử S chỉ có 6 electron sau bước 4. Do đó, ta chuyển một cặp electron từ một nguyên tử O để tạo liên kết đôi giữa S và O.
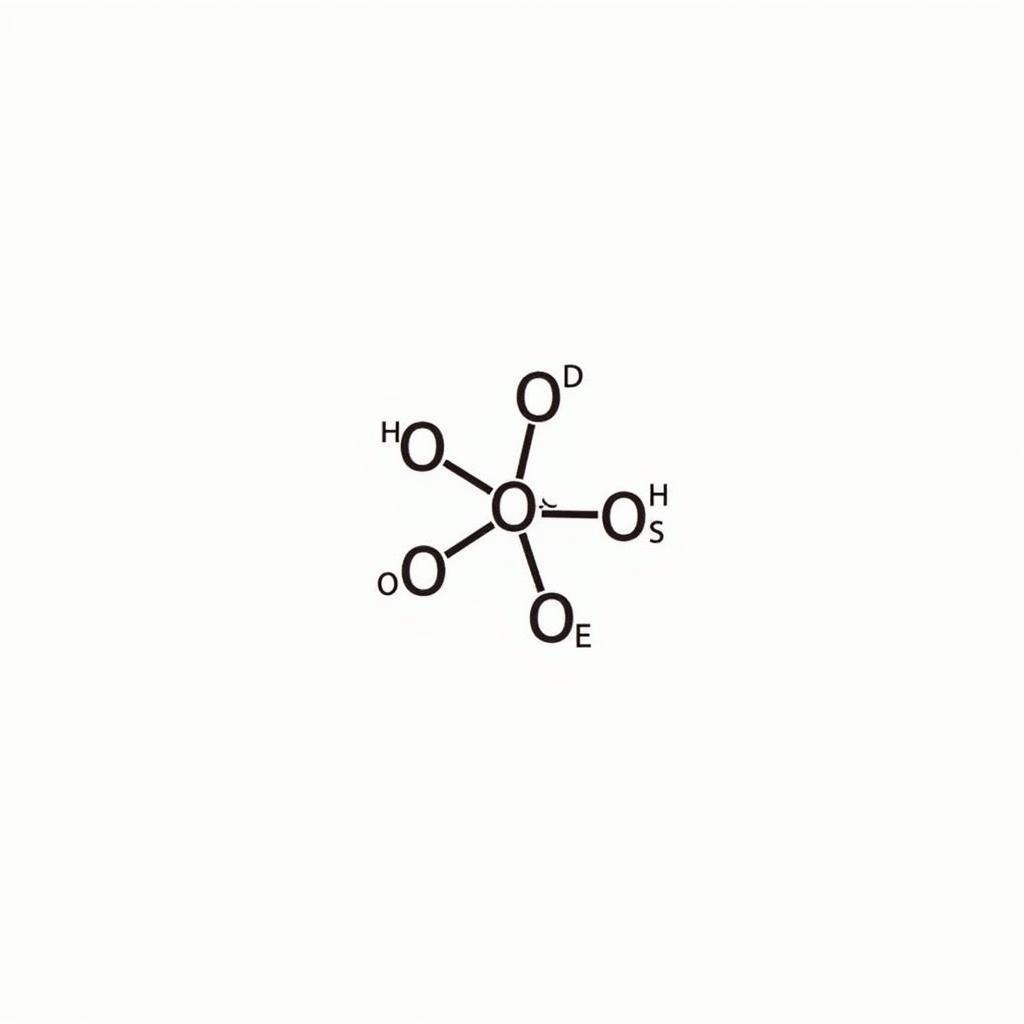 Công thức Lewis của SO2
Công thức Lewis của SO2
Kết quả là công thức Lewis của SO2 cho thấy nguyên tử S liên kết với một nguyên tử O bằng liên kết đôi và với nguyên tử O còn lại bằng liên kết đơn. Nguyên tử S còn một cặp electron tự do.
Tính Chất Và Ứng Dụng Của SO2
Hiểu được công thức Lewis của SO2 giúp ta dự đoán tính chất của nó. SO2 là một khí không màu, có mùi hắc, gây kích ứng. Nó là một chất oxy hóa và có thể phản ứng với nhiều chất khác nhau.
SO2 Trong Đời Sống: Từ Ô Nhiễm Đến Bảo Quản Thực Phẩm
SO2 có nhiều ứng dụng trong đời sống, từ bảo quản thực phẩm đến sản xuất axit sulfuric. Tuy nhiên, nó cũng là một chất gây ô nhiễm không khí, góp phần vào hiện tượng mưa axit.
 Ứng dụng của SO2
Ứng dụng của SO2
Trả Lời Các Câu Hỏi
-
What công thức lewis của so2? Công thức Lewis của SO2 thể hiện một nguyên tử lưu huỳnh liên kết đôi với một nguyên tử oxy và liên kết đơn với một nguyên tử oxy khác. Nguyên tử lưu huỳnh còn một cặp electron tự do.
-
Who sử dụng công thức lewis của so2? Các nhà hóa học và sinh viên hóa học sử dụng công thức Lewis của SO2 để hiểu cấu trúc và tính chất của phân tử này.
-
When công thức lewis của so2 được sử dụng? Công thức Lewis của SO2 được sử dụng khi nghiên cứu về cấu trúc phân tử, liên kết hóa học và các phản ứng hóa học liên quan đến SO2.
-
Where công thức lewis của so2 được áp dụng? Công thức Lewis của SO2 được áp dụng trong nhiều lĩnh vực, bao gồm hóa học, môi trường và công nghiệp.
-
Why công thức lewis của so2 quan trọng? Công thức Lewis của SO2 quan trọng vì nó giúp ta hiểu cấu trúc phân tử, từ đó dự đoán tính chất và phản ứng hóa học của SO2.
-
How vẽ công thức lewis của so2? Xem phần hướng dẫn từng bước ở trên để biết cách vẽ công thức Lewis của SO2.
Bảng Giá Chi Tiết (Không áp dụng cho bài viết này)
Trích Dẫn Chuyên Gia
Theo PGS.TS Nguyễn Văn An, chuyên gia hóa học tại Đại học Khoa học Tự nhiên: “Công thức Lewis là một công cụ hữu ích để hiểu cấu trúc phân tử. Nó giúp chúng ta dự đoán tính chất và phản ứng của các hợp chất hóa học.”
TS. Lê Thị Mai, nhà nghiên cứu môi trường, chia sẻ: “SO2 là một chất gây ô nhiễm không khí đáng quan tâm. Việc hiểu rõ tính chất của nó, bắt đầu từ cấu trúc phân tử, là rất quan trọng để kiểm soát ô nhiễm.”
 Ô nhiễm không khí do SO2
Ô nhiễm không khí do SO2
Kết Luận
Công thức Lewis của SO2 là một chìa khóa để hiểu rõ về cấu trúc và tính chất của phân tử lưu huỳnh đioxit. Từ việc dự đoán phản ứng hóa học đến ứng dụng trong đời sống và tác động môi trường, kiến thức về công thức Lewis của SO2 là nền tảng quan trọng.
FAQ
- SO2 có độc không? Có, SO2 là một chất khí độc, có thể gây kích ứng đường hô hấp.
- SO2 có tan trong nước không? Có, SO2 tan trong nước tạo thành axit sulfurơ.
- Làm thế nào để giảm thiểu ô nhiễm SO2? Có nhiều biện pháp để giảm thiểu ô nhiễm SO2, bao gồm sử dụng nhiên liệu sạch, lắp đặt thiết bị lọc khí, và kiểm soát khí thải công nghiệp.
- SO2 có vai trò gì trong sản xuất axit sulfuric? SO2 là nguyên liệu chính trong sản xuất axit sulfuric.
- SO2 có ảnh hưởng gì đến sức khỏe con người? SO2 có thể gây kích ứng mắt, mũi, họng và phổi. Tiếp xúc lâu dài với nồng độ SO2 cao có thể gây ra các vấn đề hô hấp nghiêm trọng.
- Mưa axit là gì và SO2 có liên quan gì đến mưa axit? Mưa axit là hiện tượng mưa có độ pH thấp hơn bình thường do sự hiện diện của các oxit axit trong khí quyển, bao gồm SO2. SO2 phản ứng với nước trong khí quyển tạo thành axit sulfurơ và axit sulfuric, góp phần vào hiện tượng mưa axit.
- SO2 được sử dụng trong bảo quản thực phẩm như thế nào? SO2 được sử dụng làm chất bảo quản thực phẩm bằng cách ức chế sự phát triển của vi khuẩn và nấm mốc.
- Có những nguồn phát thải SO2 nào? Các nguồn phát thải SO2 bao gồm nhà máy nhiệt điện, hoạt động công nghiệp, núi lửa và phương tiện giao thông.
- Làm thế nào để phát hiện sự hiện diện của SO2? Có thể phát hiện SO2 bằng các phương pháp hóa học hoặc sử dụng các thiết bị cảm biến khí.
- SO2 có tác dụng gì trong sản xuất rượu vang? SO2 được sử dụng trong sản xuất rượu vang để ngăn chặn quá trình oxy hóa và sự phát triển của vi sinh vật.
